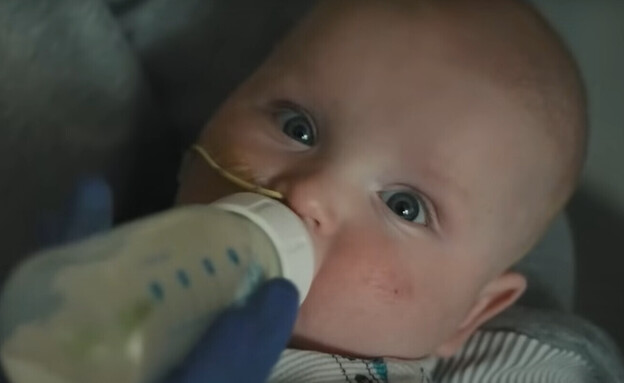
פחות מ-48 שעות לאחר לידתו של קיי־ג’יי מולדון (KJ Muldoon), באוגוסט 2024, היה ברור שמשהו מאוד לא בסדר. הוא היה ישנוני הרבה יותר מהצפוי וסבל מקשיי נשימה. בדיקות הדם שלו הראו שרמות האמוניה בדמו גבוהות ברמה מסוכנת, ובדיקות נוספות גילו שהוא לוקה במחסור באנזים CPS1, מחלה גנטית נדירה ביותר שאחד מכל שני חולים בה מת בחודשים הראשונים לחייו. אלו שלא מתים סובלים לרוב מעיכוב התפתחותי וממוגבלות שכלית.
עם זיהוי המחלה פתחו רופאיו של קיי־ג’יי במרוץ לפיתוח טיפול גֵני מותאם אישית, שיתקן את השגיאה המסוימת בקוד הגנטי שלו. הם הצליחו לעשות זאת בשישה חודשים בלבד, ומולדון הצעיר היה לאדם הראשון שטופל בעריכת גנים שנועדה לו בלבד. הצלחה זו סוללת את הדרך לטיפולים גניים מותאמים אישית במחלות גנטיות נדירות שכיום הן חֲשׂוּכוֹת מרפא.
הכתבה פורסמה במקור באתר מכון דוידסון לחינוך מדעי
בגלל האמוניה
קיי־ג’יי, ילדם הרביעי של ניקול וקייל מולדון, נולד בפנסילבניה כמה שבועות לפני הזמן אך בריא למראה. עד מהרה הוא פיתח תסמינים שגרמו לרופאיו לחשוד שהוא סובל מדלקת קרום המוח או מאלח דם – תגובה מוגזמת ומסכנת חיים של הגוף לזיהום בדם. אולם, בזכות הערנות של מטפליו, התגלו רמות האמוניה הגבוהות בדמו ורופאיו הבינו שמצבו הקשה לא נובע מזיהום.
התינוק הועבר לבית החולים לילדים של פילדלפיה (CHOP), שם הצוות הרפואי החל בטיפול לסילוק עודפי האמוניה מגופו. בבית החולים גם מיפו את הרצף הגנטי של קיי־ג’יי וגילו פגם בשני העותקים של הגן שאחראי לייצור האנזים CPS1. כלומר גופו לא יכול לייצר את האנזים, שמשתתף בשלב הראשון והחיוני של מעגל השתנן (אוריאה), מנגנון שמאפשר לגוף להיפטר מאמוניה, שהיא תוצרת לוואי רעיל של פירוק חלבונים, על ידי המרתה לשתנן. 
אצל אנשים בריאים השתנן נוצר מאמוניה בכבד, משם מופרש למחזור הדם, ולבסוף מגיע לכליות ויוצא בשתן, אך אצל אנשים שאין להם CPS1 תקין האמוניה מצטברת בגוף לרמות רעילות. זהו מצב מסכן חיים, מאחר שאמוניה רעילה במיוחד לתאי עצב, ויכולה לגרום לנזק עצבי, תרדמת (קומה) ומוות. זהו גם מצב נדיר יחסית, שמתגלה רק באחד מכל 1.3 מיליון יילודים.
הטיפול במחסור באנזים כולל הפחתת החלבון בתזונה של החולים ומתן תרופות שעוזרות לפנות את האמוניה מהגוף, עד שהם גדולים דיים להשתלת כבד שמעגל השתנן בו תקין. אולם, בזמן הזה קפיצות ברמת האמוניה – למשל בעקבות מחלה זיהומית – מובילות לרוב לנזק מוחי בלתי הפיך ואף למוות.
מהר ככל האפשר
“כשגיגלנו ‘מחסור באנזים CPS1’, ראינו שיש שתי תוצאות אפשריות – השתלת כבד או מוות”, סיפרה האם ניקול. “היינו בהלם”. עקב כך היא ובן זוגה החליטו להשאיר את קיי־ג’יי בבית חולים באשפוז מלא למשך כמה זמן שידרש, כדי שיקבל טיפול סביב השעון שיעלה את סיכוייו לשרוד. בגלל מצבו הקשה כבר בגיל חמישה חודשים הוא נכנס לרשימת המתנה להשתלת כבד, השתלה שעלולה להגיע מאוחר מדי.
במקביל, החל הצוות המטפל בתינוק לפתח טיפול שאולי יוכל לתקן את אחד העותקים של הגן הפגום בכבד שלו. רבקה ארנס-ניקלס (Ahrens-Nicklas), רופאה וחוקרת מבית החולים לילדים של פילדלפיה, וקיראן מוסונורו (Musunuru), רופא וגנטיקאי מאוניברסיטת פנסילבניה, ועמיתיהם תיארו את המרוץ לפיתוח טיפול גני במאמר בכתב העת הרפואי New England Journal of Medicine.
ארנס-ניקלס ומוסונורו משתפים פעולה כבר כמה שנים בניסיון למצוא דרך לתקן את הטעויות הגנטיות, המוטציות, בכבד של ילדים שלוקים בהפרעות במעגל השתנן. לשם כך הם התמקדו ב”עריכת בסיס“, שיטת עריכה גנטית מבוססת קריספר (CRISPR) שמאפשרת לשנות בסיס יחיד, “אות” יחידה, ב-DNA. מערכת קריספר, שהשימוש של מדענים בה החל רק בעשור שעבר, חוללה מהפכה בתחום ההנדסה הגנטית. היא מאפשרת לערוך גנים בקלות ובמהירות, ומתוארת לרוב כ”מספריים גנטיים” שחותכים את שני גדילי ה-DNA. עריכת בסיס לעומת זאת דומה יותר למחק ועיפרון, היא יוצרת חריץ קטן באחד מהגדילים וכך מאפשרת להחליף את אחת מהאותיות ב-DNA.
כדי לעזור לילדים שנולדים עם הפרעות במעגל השתנן צריך לתקן את המוטציות בגופם כמה שיותר מהר, לפני שנוצר נזק בלתי הפיך. לשם כך פיתחו ארנס-ניקלס ומוסונורו תהליך עבודה שיאיץ ככל האפשר ייצור של מערכת עריכת בסיס מותאמת אישית, מרגע גילוי המוטציה המסוימת הקשורה למחלה של המטופל. החוקרים התאמנו על התהליך: הם בחרו שגיאה גנטית שעלולה לגרום להפרעה במעגל השתנן, ואז עבדו כמה שיותר מהר לפיתוח עורך מתאים. בכל ניסוי שלהם הם הצליחו לקצר את הזמן שנדרש למציאת פתרון – מיותר משנה לכמה חודשים.
המוטציה של קיי־ג’יי הייתה השביעית שניסו לתקן במהירות, אך הפעם לא היה מדובר באימון במעבדה אלא בתינוק חולה אמיתי.
מרוץ נגד הזמן
ארנס-ניקלס, מוסונורו והצוות שלהם, בשיתוף חוקרים מהמכון לגנומיקה חדשנית (IGI) של אוניברסיטת קליפורניה בברקלי וחברות ביוטכנולוגיה, ובעזרת מימון פדרלי מהמכונים האמריקאיים הלאומיים לבריאות (NIH), פיתחו טיפול גני לקיי־ג’יי בזמן שיא. הם עבדו כמעט ללא הפסקה, כולל בחגים. כשקיי־ג’יי הגיע לגיל חודש החוקרים כבר גידלו תרביות תאים עם המוטציה המסוימת שלו, כדי שיוכלו לבדוק עליהן את הטיפול. כעבור חודש נוסף הייתה בידי החוקרים מערכת עריכת בסיס.
המערכת עצמה עטופה בבועית שומנית זעירה ששומרת עליה ועוזרת לה לחדור לתאי הכבד. בתוך הבועית ארוזות ההוראות שגורמות לתאים לייצר את העורך, וכן רצף גנטי קטן (gRNA) שמכוון את העורך בדיוק למקום שבו צריך לתקן את האות השגויה באחד מעותקי הגֵן ב-DNA של קיי־ג’יי. רצף זה קיבל את השם “kayjayguran”, על שם התינוק. חיסוני הקורונה משתמשים בבועיות דומות, שלא נושאות הוראות לשינוי הרצף הגנטי, אלא הוראות שגורמות לתאים באזור שאליו הוזרקו לייצר זמנית חלבון מסוים של הנגיף.
חמישה חודשים לאחר לידתו של קיי־ג’יי נבדק הטיפול הגני המוכן, שקרוי “k-abe”, בתרביות התאים ובעכברים מהונדסים גנטית שנשאו את הגן הפגום. התברר שהוא הצליח לתקן את הפגם, אך כפי שקורה לעתים קרובות במערכת קריספר הוא שינה את ה-DNA לא רק באזור שאותו רצו החוקרים לערוך. עם זאת, בדיקות הראו שהשינוי הגנטי באזורים אחרים ב-DNA לא גרם נזק. הדבר דומה לתיקון שגיאת הכתיב במשפט “לחטולים יש הרבה אמונות טפלות”, כך שלאחר התיקון יתקבל המשפט “לחתולים יש הרבה אמונות תפלות”. השינוי מחוץ למילה “לחתולים” לא שינה את משמעות המשפט, ולכן אינו מזיק.
במקביל לבדיקות האלו החוקרים בדקו גם את בטיחות הטיפול בקוף מקוק. כשקיי־ג’יי היה בן שישה חודשים הגישו החוקרים למינהל המזון והתרופות של ארצות הברית (ה-FDA) את תוצאות הבדיקות, ובקשה לאישור הטיפול כתרופה ניסיונית חדשה למטופל יחיד. המינהל אישר את הבקשה תוך שבוע, וכמה חברות ביוטק יצרו במשותף, ובמחיר עלות, את הטיפול באיכות שמתאימה לשימוש בבני אדם.
תקווה חדשה
לאחר שהחוקרים ידעו שיש בידם טיפול מאושר, סיפרה סוף סוף ארנס-ניקלס להוריו של קיי־ג’יי שאולי יש לה חדשות טובות. “הפחד הכי גדול שלי היה לטעת במשפחה תקוות שווא”, אמרה.
ניקול וקייל בחרו בטיפול. “הילד שלנו היה חולה. היינו צריכים לבחור בין השתלת כבד לבין מתן התרופה הזו, שמעולם לא ניתנה לאיש”, אמר קייל. “זו הייתה בחירה בלתי אפשרית, אבל הרגשנו שזו הייתה האפשרות הטובה ביותר כדי לתת לו חיים, שבשלב מסוים כלל לא ידענו אם יהיו לו”.
ב-25 בפברואר קיבל קיי־ג’יי בן השישה חודשים עירוי ראשון, מתוך שלושה שאושרו, של הטיפול, במינון נמוך מאוד. במרץ ובסוף אפריל קיבל שתי מנות נוספות, במינון גבוה יותר. מצבו השתפר כמעט מיד: הוא יכול לאכול יותר חלבון, רופאיו הפחיתו במחצית את מינון התרופות שהוא מקבל, ואפילו מחלות נגיפיות לא גרמו לזינוק ברמת האמוניה בדמו, אף שזה מאפיין חולים כמוהו. הוא גם עלה במשקל, מאחוזון 7 מיד לפני קבלת העירוי הראשון לאחוזון 40 כיום, בגיל 9.5 חודשים. נוסף על כך, קיי־ג’יי לא ממתין, לעת עתה, להשתלת כבד, אם כי לא ידוע אם יצטרך כזו בעתיד.
הטיפול לא ריפא אותו, אך הפך את המחלה שלו לקלה בהרבה. “אף על פי שיהיה צריך לנטר את קיי־ג’יי בקפידה למשך שארית חייו, הממצאים הראשוניים שלנו מעודדים למדי”, אמרה ארנס-ניקלס בהודעה לעיתונות.
חלפו רק כמה שבועות מאז שהוא קיבל את העירוי האחרון, ומוקדם עדיין לדעת אם השיפור במצבו של קיי־ג’יי יימשך לאורך זמן, אם יהיו לו תופעות לוואי ארוכות טווח מהטיפול, ואם יוכל בעתיד להפסיק ליטול תרופות לסילוק אמוניה. כמו כן, כרגע אין דרך לדעת את שיעור הצלחת עריכת הגנים בכבד של קיי־ג’יי, ואם התרחשו שינויים גנטיים לא רצויים. כדי לבדוק זאת החוקרים יצטרכו ליטול ביופסיה (דגימות רקמה) מהכבד שלו, הליך מסוכן מדי לתינוק בגילו.
עם זאת, בזכות הטיפול והשיפור האדיר במצבו קיי־ג’יי כבר לא זקוק לאשפוז מלא, ויצא בקרוב לביתו. “אנחנו נרגשים כל כך שסוף סוף נוכל להיות כולנו יחד בבית”, אמר קייל. “כדי שקיי־ג’יי יוכל להיות עם האחים שלו, ואנחנו נוכל סוף סוף לנשום לרווחה”.
למאמרים נוספים באתר מכון דוידסון לחינוך מדעי
התפרסם במקור באתר "תיבת נעם – מחשבות ביולוגיות"